搜索

海马一直以来被认为在记忆过程当中具有重要影响。著名的关于Henry Molaison的研究表明海马对于陈述性记忆的形成过程起到不可缺少的关键作用(Dossani,Missios et al.2015)。对于啮齿类动物,损伤海马会造成选择性空间认知损伤(Cohen,Munchow et al.2013)。O'Keefe在1971年发现了海马在空间记忆中的神经物理对应,从而开创了海马体作为认知地图功能的研究(O'Keefeand Dostrovsky 1971)。
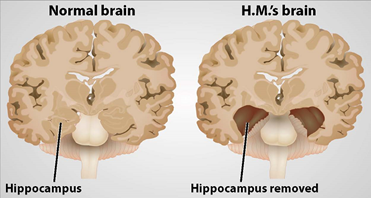
图1. 普通人大脑与Henry Molarson的大脑的比较。(https://www.brainfacts.org/)
1.个体位置与路径表示
一个表征认知地图的脑区需要什么功能?首先,它需要对个体所经过的路线进行神经表示,这是空间记忆的重要组成部分。通过标记个体在各个时间点的位置先后关系,可以构成个体在这一段时间内的路径记忆。O’Keefe的研究在海马中发现了一些具有特殊峰电位活动的锥体细胞,这些细胞只有在大鼠到达特定空间位置的时候才放电,于是称之为位置细胞。在个体进入新环境后的短时间内,位置细胞就可以形成稳定的放电模式。随后个体在这个环境中所处的任意空间位置,都会有至少一个位置细胞特异性放电表征这个位置(图2)。海马体中位置细胞放电的时间序列就形成了个体空间路线记忆的神经表示。移除环境刺激后,海马的位置细胞仍然可以以特定时间序列的形式重播发放,表明位置细胞对于空间环境的编码具有持续性,且不必须要求个体处在环境中。进一步研究表明,位置细胞不仅仅对环境空间位置进行了编码,也产生了对空间位置的记忆。根据这个记忆,小鼠就具备了目标导向的导航能力。来自位置细胞的简短时间序列发放影响了个体对于全新目标路径的预期,使得该预期偏向于既往记忆中的目标位置(Pfeifferand Foster 2013)。这说明位置细胞的重播发放还具有路线寻找的功能,通过匹配识别当前位置与既往位置中重要位置标志的重合部分来引导个体行为更高效地找到可能的目标。总体来说,海马的位置细胞通过特异性发放表征了个体的当前位置,通过各个重播位置细胞的发放形成路径记忆,并且提供新路径目标的预测。
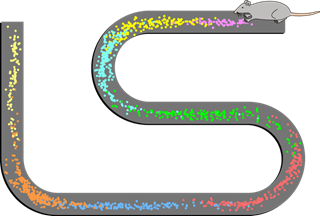
图2. 位置细胞覆盖了小鼠的路线任务空间。(https://zhuanlan.zhihu.com/)
2. 全局地图的表示
光依靠位置细胞进行空间导航任务并不足够,因为位置细胞本身并不表征空间位置的拓扑关系。因此位置细胞能提供的信息是前一秒位于位置A,后一秒位于位置B,并形成了从A到B的路径,但是无法表示A与B之间的空间关系。在内嗅皮层当中发现了网格细胞,与位置细胞共同构成脑认知地图(Hafting,Fyhn et al. 2005)。网格细胞在二维环境中的编码模式呈现出六边形特征(图3),因为每个网格细胞在同一个环境当中具有多个位置野,位置野的相对位置形成等边三角形的规则周期性排列。另外,网格细胞对应环境空间具有拓扑关系:邻近网格细胞的发放野与邻近网格细胞之间等距离分布,这样的特征使网格细胞群可以构成对欧式空间的表征。另外,栅格细胞的编码随着环境变化而发生等比例的响应变化。旋转环境当中的空间标志物使得栅格细胞的编码发生同样的偏转;将环境整体比例缩小引起栅格细胞编码的比例尺对应缩小(Barry, Hayman et al.2007)。这表明栅格细胞的编码是依赖于整体空间的。另外,在环海马的脑区中还有一些栅格细胞也受到头部朝向的调制,成为联合栅格细胞(Sargolini, Fyhn et al.2006)。联合栅格细胞不仅仅表征了环境的拓扑特征,也表征了头部的朝向面对在环境当中的那个特定方向,从而编码了环境中的异己坐标系。
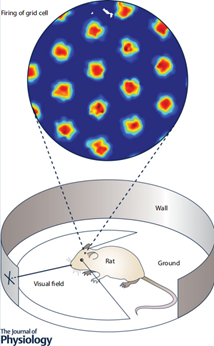
图3. 小鼠单个网格细胞的多感受野之间的位置关系呈现六边形特征,相邻的三个感受野具有等边三角形特征(Raudies, Hinman et al.2016)。
3. 抽象关系的表示
一项功能核磁共振显示,海马不仅可以表征空间地图信息,也可以表征非物理空间的抽象信息(Schuckand Niv 2019)。在这项研究中,被试者需要在连续的试次中整合来自前两个试次的信息,对当前试次的信息进行认知决策。对于实验中的抽象序列信息,海马神经元同样表现出有序放电的特征,说明信息在海马的回放对于大脑建立复杂和抽象任务的表征非常重要。累积证据实验可以用来研究在复杂环境中进行抽象感知行为决策的机制(Pinto,Koay et al. 2018)。累积证据实验设计了一个T型迷宫,小鼠的起点位于T型迷宫的长柄端(图4),在T型迷宫的短柄两侧进行决策验证,一侧有糖水奖励,另一侧则是延时惩罚。在实验的过程中,小鼠在向前移动时会遇到闪光刺激,闪光刺激可能出现在左或右的其中一侧。双侧的闪光刺激都符合泊松分布,但是均值不同。小鼠需要累积来自T型迷宫长柄全程的闪光刺激作为证据,并判断来自左或右的哪一侧的闪光刺激总数更多,总数更多的那一侧对应奖励。通过重复实验统计正确率,可以得到小鼠在做此实验的行为决策对应的心理物理函数。此函数可以由Sigmoid函数拟合,表现出随着闪光刺激差异增大正确率缓慢升高的特征。这说明小鼠在实验中可以逐步累积经过迷宫长柄的过程中所获得的闪光证据,最后综合证据的数目作出判断。
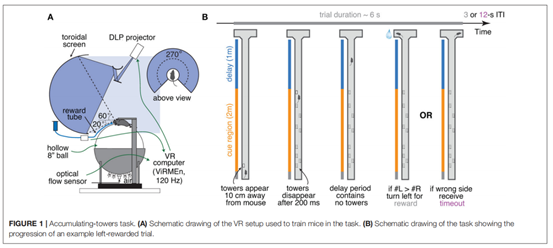
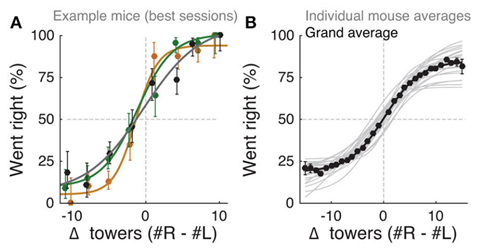
图4. 累积证据实验范式以及小鼠的心理物理函数。(Pinto, Koay et al.2018)
为了研究这些外在的抽象特征如何整合成为神经元的表现形式,Edward等人(Nieh,Schottdorf et al. 2021)在小鼠进行累积证据实验的同时对海马CA1区神经元进行了单细胞记录。实验假设CA1区神经元可能具有两种编码性质:一是单纯的位置细胞特征。小鼠在T型迷宫长柄上移动时,每个空间位置都应该可以找到特定的位置细胞发放达到最大响应。如果只具有这一特征,那么小鼠不论收到的闪光证据如何,它在同一位置附近的重复多次移动应该让这些神经元排布形成完全一致的响应序列。二是多维度表征特征。具有这个特征的神经元不仅仅在特定的位置达到最大响应,同时也会对特定的证据积累阶段达到最大响应,也就是具有二维编码的特征。比如,一个神经元在小鼠移动到100cm时候达到最大响应,并且在右侧闪光为3次时达到最大响应。另一个神经元在小鼠移动到200cm时候达到最大响应,并且还会在右侧闪光达到5次时达到最大响应。具有这一特征的神经元会产生一个重要特征,那就是它的空间地图表征并不会像位置细胞那么精准,因为神经元的响应同时受到两个变量的影响,有可能在它的特定兴奋位置却没有产生强烈的兴奋。这就会造成神经元信息表达的失真。研究发现,CA1区的部分神经元确实具有这种多维度信息表征的能力。这些神经元可以对证据空间的几段证据(3次闪光、5次闪光等情况)产生兴奋感受,如果证据的累积总数落在这个范围内,神经元的活性就会增强。进一步研究发现,CA1区的神经元的群体活动主要受4-6个物理变量的影响。这表明神经元的活动受到低维流形的限制。尽管在不同的刺激单独呈现时同一个神经元都能形成抽象的发放野并且表征特异性的信息,但是多种刺激同时呈现时一个神经元的发放只能具有有限的状态,该状态限制了神经元对于多种信息的表征。
4. 海马丰富的表征神经生物学基础
尽管如此,不可否认的是海马仍然编码了非常丰富的外部表征信息。为什么有限的神经元发放模式可以表征丰富的信息?其中一个原因是海马神经元的树突上具有结构多变的树突棘(Smith1999)。树突棘结构使得神经元之间的连接大量丰富,从而使信息的编码容量呈指数增长,而海马树突棘的结构随着时间会变化,不仅有快变化还有慢变化。可变化的树突棘进一步扩大了信息容量。钙水平升高也能够重塑树突棘的长度,从而造成树突棘的变化。二是每个树突棘本身的形态也具有多样性。一些树的突棘狭窄颈部能够放大突触的电压变化,易化了神经元之间的交流,另一些则没有这样的变化(图5)。这样的形态多样性会造成钙动力学特异性(Yuste,Majewska et al.2000),这个动力学差异可以在突触上造成不同的发放事件,从而编码信息多样性。
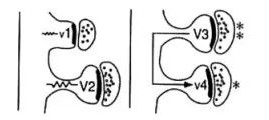
图5.树突棘放大突触电信号并促进相邻突触的连接。(图片来自(Sorra and Harris 2000))
总体而言,海马区的部分神经元可以表征不同维度的物理参数,这种表征响应可以通过神经元的发放来验证,但是如此的对应关系并不完整,信息具有一定失真性。完整的海马信息处理过程可能还依赖于更微观的调控,比如海马神经元树突棘的多样性通过钙离子电流的变化造成不同的事件发放,从而提高信息编码的容量。值得一提的是海马的空间地图表征仍然缺少一个主流模型能够均衡认识行为和神经元响应之间的关系,这是空间记忆的机制研究当中关键的一环。
文:张佳伟
【参考文献】
1. Barry, C., R. Hayman, N. Burgess and K. J. Jeffery (2007)."Experience-dependent rescaling of entorhinal grids." Nat Neurosci10(6): 682-684.
2. Cohen,S. J., A. H. Munchow, L. M. Rios, G. Zhang, H. N. Asgeirsdottir and R. W.Stackman, Jr. (2013). "The rodent hippocampus is essential for nonspatial object memory." Curr Biol 23(17):1685-1690.
3. Dossani,R. H., S. Missios and A. Nanda (2015). "The Legacy of Henry Molaison(1926-2008) and the Impact of His Bilateral Mesial Temporal Lobe Surgery on the Study of Human Memory." World Neurosurg 84(4): 1127-1135.
4. Hafting,T., M. Fyhn, S. Molden, M. B. Moser and E. I. Moser (2005)."Microstructure of a spatial map in the entorhinal cortex." Nature436(7052): 801-806.
5. Nieh, E.H., M. Schottdorf, N. W. Freeman, R. J. Low, S. Lewallen, S. A. Koay, L. Pinto,J. L. Gauthier, C. D. Brody and D. W. Tank (2021). "Geometry of abstract learned knowledge in the hippocampus." Nature.
6. O'Keefe,J. and J. Dostrovsky (1971). "The hippocampus is a spatial map. Preliminary evidence from unit activity in the freely-moving rat." BrainRes 34(1): 171-175.
7. Pfeiffer,B. E. and D. J. Foster (2013). "Hippocampal place-cell sequences depict future paths to remembered goals." Nature 497(7447): 74-79.
8. Pinto,L., S. A. Koay, B. Engelhard, A. M. Yoon, B. Deverett, S. Y. Thiberge, I. B.Witten, D. W. Tank and C. D. Brody (2018). "An Accumulation-of-Evidence Task Using Visual Pulses for Mice Navigating in Virtual Reality." FrontBehav Neurosci 12: 36.
9. Raudies,F., J. R. Hinman and M. E. Hasselmo (2016). "Modelling effects on grid cells of sensory input during self-motion." J Physiol 594(22): 6513-6526.
10. Sargolini,F., M. Fyhn, T. Hafting, B. L. McNaughton, M. P. Witter, M. B. Moser and E. I.Moser (2006). "Conjunctive representation of position, direction, andvelocity in entorhinal cortex." Science 312(5774): 758-762.
11. Schuck, N. W. and Y. Niv (2019). "Sequential replay of nonspatial task states in the human hippocampus." Science 364(6447).
12. Smith,S. J. (1999). "Dissecting dendrite dynamics." Science 283(5409): 1860-1861.
Sorra,K. E. and K. M. Harris (2000). "Overview on the structure, composition, function, development, and plasticity of hippocampal dendritic spines." Hippocampus10(5): 501-511.
13. Yuste,R., A. Majewska and K. Holthoff (2000). "From form to function: calciumcompartmentalization in dendritic spines." Nat Neurosci 3(7): 653-659.


 loading......
loading......